Cell主刊 | MST助力人體抑癌基因研究取得新發(fā)現(xiàn)!
01研究背景
在正常血氧水平的典型細(xì)胞中,大多數(shù)丙酮酸進入線粒體,并由三羧酸循環(huán)氧化生成 ATP 來滿足細(xì)胞的能量需求。然而,在癌細(xì)胞或其他高度增殖的細(xì)胞類型中,糖酵解產(chǎn)生的大部分丙酮酸離開線粒體并通過乳酸脫氫酶 (LDH/LDHA) 的作用產(chǎn)生乳酸, 這一過程通常是在低氧狀態(tài)時才會出現(xiàn)。有氧情況下產(chǎn)生乳酸稱為“有氧糖酵解”或 Warburg 效應(yīng),它是腫瘤代謝改變的最早證據(jù)之一。
p53基因,人體抑癌基因。該基因編碼一種分子量為43.7KDa的蛋白質(zhì),但因蛋白條帶出現(xiàn)在Marker所示 53 kDa處,命名為p53蛋白。該蛋白的失活對腫瘤形成起重要作用,是一個關(guān)鍵的腫瘤抑制蛋白。
p53作為轉(zhuǎn)錄因子,它通過激活控制DNA修復(fù)、細(xì)胞周期進程靶基因來保護細(xì)胞免受惡性轉(zhuǎn)化。在腫瘤發(fā)生過程中,p53的活性會受到磷酸化、乙酰化和泛素化等翻譯后修飾的調(diào)控。癌細(xì)胞的代謝改變導(dǎo)致乳酸等糖酵解中間體的積累,這些乳酸不僅支持細(xì)胞增殖,還參與調(diào)節(jié)免疫細(xì)胞分化、腫瘤免疫監(jiān)視等多種生物學(xué)過程。盡管目前已知乳酸可以共價修飾蛋白質(zhì),但是其乳酸化的具體機制尚不清楚,同樣目前對于p53與乳酸化之間的關(guān)聯(lián)也知之甚少。
?
02研究內(nèi)容
2024年4月22日,蘇州大學(xué)生物醫(yī)學(xué)研究院周芳芳教授團隊在?Cell??發(fā)表題為“Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis”?的研究論文。

DOI: 10.1016/j.cell.2024.04.002
?
在這篇研究中,課題組發(fā)現(xiàn)腫瘤源性乳酸是p53的天然抑制劑,可促進p53乳酸化,全基因組CRISPR篩選確定了AARS1是腫瘤細(xì)胞中全局賴氨酸乳酸化的介質(zhì)。AARS1耗竭的腫瘤細(xì)胞中增殖、集落形成能力顯著降低,并且AARS1的耗竭抑制了乳酸誘導(dǎo)的賴氨酸乳酸化。另外,β-丙氨酸在結(jié)構(gòu)上類似于乳酸,研究者發(fā)現(xiàn)用其預(yù)處理的細(xì)胞賴氨酸乳酸化減少。這些生理表象背后的分子機制,研究者仍需要進行進一步探究。
?
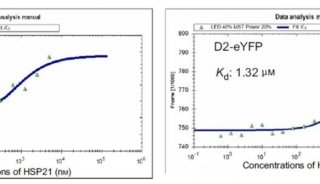
借助NanoTemper公司的MST技術(shù),研究者驗證證實了AARS1蛋白(EcAlaRS細(xì)菌酶、HsAlaRS人源酶)在分子層面上與乳酸的結(jié)合,乳酸與EcAlaRS、乳酸與HsAlaRS的Kd值分別為13 μM和35 μM(圖1A),表明EcAlaRS和HsAlaRS可以使用乳酸作為底物直接催化乳酸化。同時,通過MST實驗,研究了β-丙氨酸與AARS1的互作,Kd值為2.7 μM(β-alanine與EcAlaRS) 和4.0 μM(β-alanine與HsAlaRS)(圖1B), β-丙氨酸有著更強的親和力。MST的結(jié)果在分子層面上非常直觀地給出了β-丙氨酸可以抑制乳酸化的結(jié)果,從而闡明了生理上β-丙氨酸的拮抗乳酸化的機制(圖1C、D)。
?


圖1.AASR1與乳酸互作(A),AASR1與β-丙氨酸互作(B), β-丙氨酸與乳酸競爭結(jié)合機制(C), β-丙氨酸抑制乳酸結(jié)合AASR1(D)
?
但是,AARS1結(jié)合了乳酸其后續(xù)是如何靶向到p53上的呢?
?
為了尋找答案,研究人員進行了分子對接模擬及關(guān)鍵位點突變pull-down實驗,采用質(zhì)譜分析結(jié)合MST實驗的方式,發(fā)現(xiàn)AARS1 通過 ATP 依賴的方式催化形成乳酸-AMP 中間體,隨后將乳酸轉(zhuǎn)移至目標(biāo)蛋白的賴氨酸殘基上,可實現(xiàn)共價結(jié)合。這一過程不僅在人類中,也在大腸桿菌中觀察到,表明 AARS1 在物種間具有催化賴氨酸乳酸化的古老功能。
?
通過MST實驗,研究者們得到了驗證,HsAlaRS和EcAlaRS在體外直接與p53結(jié)合,p53與HsAlaRS和p53與EcAlaRS的Kd分別達(dá)到39 μM和21 μM,定量確認(rèn)了pull-down實驗的結(jié)果(圖2A、B)。結(jié)合其他生化實驗提出描述AlaRS介導(dǎo)的乳酸化的工作模型(圖2C):AlaRS首先與乳酸結(jié)合,在ATP存在下形成乳酸AMP和PPi;在底物蛋白存在的情況下,AlaRS將丙酰基轉(zhuǎn)移到底物蛋白上的賴氨酸殘基上。
?

?

圖2.p53與HsAlaRS和p53與EcAlaRS定性pull-down結(jié)果(A), p53與HsAlaRS和p53與EcAlaRS互作(B), AlaRS介導(dǎo)的乳酸化的工作模型(C)
?
后續(xù)進一步通過質(zhì)譜分析和抗體識別確認(rèn)了p53上乳酸化的殘基是K120和K139。通過MST實驗直接比較了乳酸化p53(p53Lac)與非乳酸化p53(p53Non-Lac)對含有p53應(yīng)答元件的DNA(p53RE-DNA)的親和力,乳酸化p53(p53K120-Lac、p53K139Lac和p53-Dual-Lac)對p53RE-DNA的親和力分別降低了約100倍、10倍和1000倍(圖3)。之后的生化生理實驗進一步表明p53的位點特異性乳酸化減弱了它們的DNA結(jié)合和液-液相分離(LLPS),從而降低了p53的抑瘤作用。
?
?

圖3.p53乳酸化減弱了其與DNA結(jié)合
?
另外,對于p53上的位點K120和K139, 各種研究表明,p53-K120N可能是無功能的,這些乳酸化模擬變體可能有助于腫瘤發(fā)生。
?
研究者通過借助MST實驗給出了有力的數(shù)據(jù)支持(圖4),純化的K120N/Q/E和K139 N/T/Q/E突變體對p53RE-DNA的結(jié)合親和力降低。K120E和K139E的減少更為明顯,表明K-to-E突變導(dǎo)致電荷減少更強。在進一步的生化活性實驗中發(fā)現(xiàn),K120N/Q和K139N/T/Q部分喪失了刺激p53反應(yīng)基因表達(dá)的能力,而K120E和K139E幾乎完全喪失了這種能力。K120、K139上的病理性突變(腫瘤發(fā)生)與p53乳酸化(腫瘤發(fā)展)都會導(dǎo)致其與DNA結(jié)合能力降低,從而活性喪失(圖4)。
?

圖4.Cy5-p53RE-DNA與p53 WT及其突變蛋白互作(左), p53中乳酸化與模擬突變(右)
?
本項研究中進行了大量的MST實驗,通過MST技術(shù),來驗證測定AARS1蛋白與腫瘤代謝產(chǎn)物(乳酸)的互作,確認(rèn)AARS1與p53(蛋白與蛋白)互作的行為, 表征蛋白突變體功能上改變。結(jié)合其他生理生化實驗完整詳細(xì)地闡述了關(guān)鍵酶AARS1與腫瘤代謝物(乳酸)在腫瘤發(fā)生和發(fā)展中重要作用,揭示了p53乳酸化失活機制,提供了一種利用β-丙氨酸阻止p53乳酸化的方法,β-丙氨酸與乳酸競爭結(jié)合AARS1,從而加強癌癥治療(圖5)。

圖5.AARS1在賴氨酸乳酸化組和p53乳酸化在腫瘤發(fā)生中的作用以及β-丙氨酸的抑制作用
?
03技術(shù)優(yōu)勢
NanoTemper公司的專利MST技術(shù)不依賴于分子量的改變,蛋白用量少,可以輕松進行蛋白與小分子代謝產(chǎn)物實驗。MST實驗是在溶液中,無需固定蛋白的實驗體系,可以便捷地設(shè)計多組分的實驗方案,驗證類似小分子的功能。在這篇研究中,除了采用標(biāo)記蛋白的方式,在檢測多種突變體蛋白與p53RE-DNA互作(蛋白與DNA)時,還選擇了標(biāo)記DNA的方式,使得實驗內(nèi)容設(shè)計更加簡潔且高效。
?
Monolith系列分子互作平臺可以更好的幫助科研人員簡便地設(shè)計互作方案,在分子層面上直觀驗證生理機制上的互作結(jié)果,為您的實驗研究提供強大助力。
?
?